Назва продукту:Метилетилкетон
Молекулярний формат:C4H8O
Номер CAS:78-93-3
Молекулярна структура продукту:
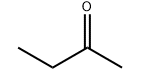
Специфікація:
| Елемент | Одиниця | Значення |
| Чистота | % | 99,8 хв |
| Колір | АФА | 8макс |
| Кислотне число (як ацетатна кислота) | % | 0,002макс |
| вологість | % | 0,03макс |
| Зовнішній вигляд | - | Безбарвна рідина |
Хімічні властивості:
Метилетилкетон схильний до різних реакцій через свою карбонільну групу та активний водень, що прилягає до карбонільної групи. Конденсація відбувається при нагріванні з хлоридною кислотою або гідроксидом натрію з утворенням 3,4-диметил-3-гексен-2-ону або 3-метил-3-гептен-5-ону. При тривалому впливі сонячного світла утворюються етан, оцтова кислота та продукти конденсації. Діацетил утворюється при окисленні азотною кислотою. При окисленні сильними окислювачами, такими як хромова кислота, утворюється оцтова кислота. Бутанон відносно стійкий до нагрівання, а термічне розщеплення за вищих температур утворює енон або метиленон. При конденсації з аліфатичними або ароматичними альдегідами утворюються високомолекулярні кетони, циклічні сполуки, кетонна конденсація та смоли. Наприклад, конденсація з формальдегідом у присутності гідроксиду натрію спочатку утворює 2-метил-1-бутанол-3-он, а потім дегідратацію до метакрилатону.
Утворення смоли відбувається під впливом сонячного світла або ультрафіолетового випромінювання. Конденсація з фенолом дає 2,2-біс(4-гідроксифеніл)бутан. Реагує з аліфатичними естерами у присутності основного каталізатора з утворенням β-дикетонів. Ацилювання з кислим ангідридом у присутності кислотного каталізатора з утворенням β-дикетонів. Реагує з ціанідом водню з утворенням ціаногідрину. Реагує з аміаком з утворенням похідних кетопиперидину. α-Атом водню бутанону легко заміщується галогенами з утворенням різних галогенованих кетонів, таких як 3-хлор-2-бутанон, шляхом взаємодії з хлором. Взаємодія з 2,4-динітрофенілгідразином утворює жовтий 2,4-динітрофенілгідразон.
Застосування:
Метилетилкетон (2-бутанон, етилметилкетон, метилацетон) – це органічний розчинник з відносно низькою токсичністю, який знаходить застосування в багатьох сферах. Він використовується в промислових та комерційних продуктах як розчинник для клеїв, фарб та мийних засобів, а також як розчинник для видалення парафіну. Метилетилкетон, природний компонент деяких харчових продуктів, може потрапляти в навколишнє середовище внаслідок виверження вулканів та лісових пожеж. Він використовується у виробництві бездимного пороху та безбарвних синтетичних смол, як розчинник та для поверхневих покриттів. Він також використовується як ароматизатор у харчових продуктах.
МЕК використовується як розчинник для різних систем покриттів, наприклад, вінілових, клейових, нітроцелюлозних та акрилових покриттів. Він використовується в засобах для зняття фарби, лаках, політурах, аерозольних фарбах, герметиках, клеях, магнітних стрічках, друкарських фарбах, смолах, каніфолях, розчинах для чищення та для полімеризації. Він міститься в інших споживчих товарах, наприклад, побутових та хобі цементах, а також у виробах для шпаклівки деревини. МЕК використовується для депарафінізації мастильних масел, знежирення металів, у виробництві синтетичної шкіри, прозорого паперу та алюмінієвої фольги, а також як хімічний проміжний продукт та каталізатор. Він є екстракційним розчинником при переробці харчових продуктів та харчових інгредієнтів. МЕК також може використовуватися для стерилізації хірургічного та стоматологічного обладнання.
Окрім виробництва, до джерел МЕК у навколишньому середовищі належать вихлопні гази реактивних двигунів та двигунів внутрішнього згоряння, а також промислова діяльність, така як газифікація вугілля. Він міститься у значних кількостях у тютюновому димі. МЕК виробляється біологічно та був ідентифікований як продукт мікробного метаболізму. Він також був знайдений у рослинах, феромонах комах та тканинах тварин, і МЕК, ймовірно, є другорядним продуктом нормального метаболізму ссавців. Він стабільний за звичайних умов, але може утворювати пероксиди при тривалому зберіганні; вони можуть бути вибухонебезпечними.
Категорії продуктів
-

Телефон
-

Електронна пошта
-

WhatsApp
-

Верх













